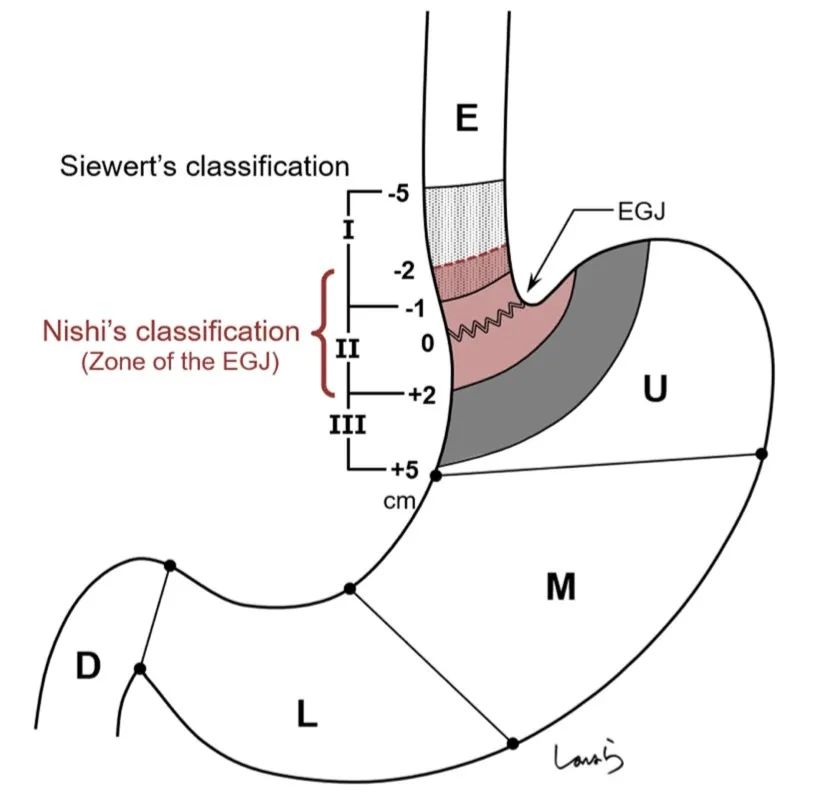
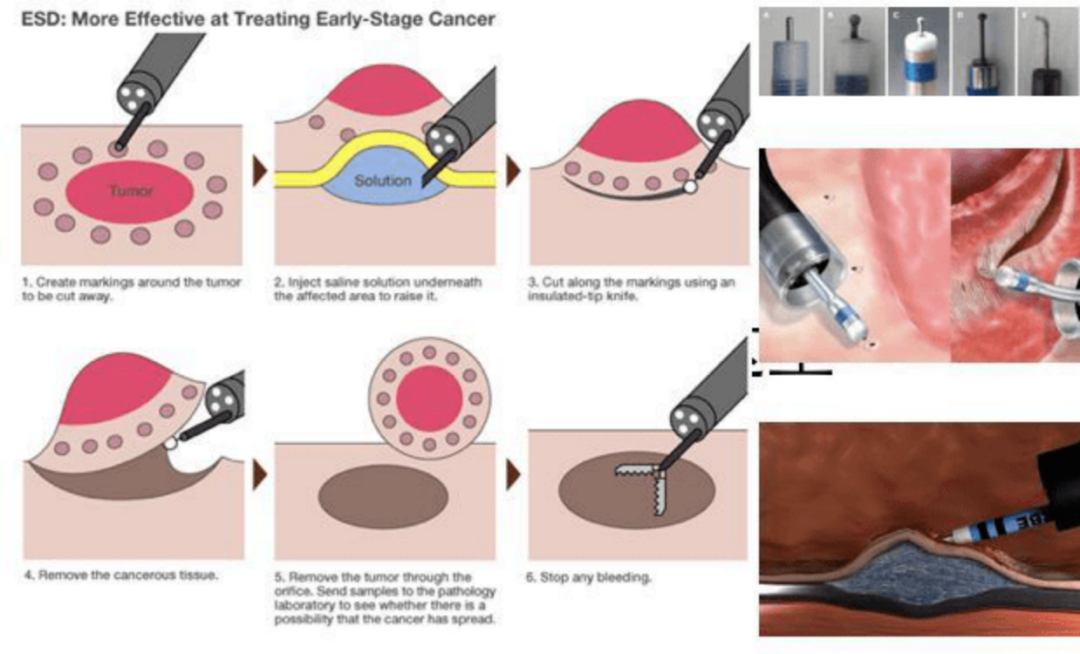
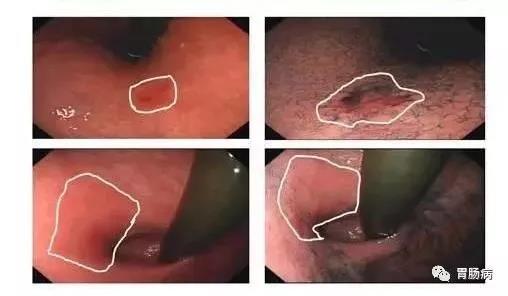
食管胃结合部(esophagogastric junction, EGJ)是连接食管下段和胃上部的一段区域,该区域的定义目前还存在一些争议,内镜下表现为食管下端纵行栅栏状血管末梢或胃黏膜皱襞的近侧缘,而外科临床应用中一般指的是管状食管与囊状胃之间结合处所在虚拟解剖交界线。 该区域管腔狭窄,易受反流的胃酸刺激[1]。在亚洲,由于幽门螺旋杆菌(Hp)感染率的降低以及胃食管反流病和肥胖的发生率升高,该部分人群的食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)发病率逐渐增加[2]。 食管胃结合部息肉样隆起在临床和内镜检查中并不少见,该类病变有癌变的可能或已伴随癌变,因此内镜下的早诊早治对改善患者预后至关重要。 AEG的定义及分型? 《食管胃结合部腺癌外科治疗中国专家共识(2018年版)》将AEG定义如下:肿瘤中心处于EGJ上下5cm范围以内的腺癌,并跨越或接触EGJ。AEG分型以Siewert分型[3]和日本的Nishi分型[4]较为常见(图1)。 其中Siewert分型在国际上的认可度更高一些,Siewert根据肿物所在位置将AEG分为三型: 肿瘤中心位于EGJ上1~5cm并向下生长累及EGJ者称为I型; 肿瘤中心位于齿状线上1cm至下2cm并累及EGJ者称为II型 肿瘤中心位于EJG以下2~5cm者并向上生长累及EGJ者为III型。 AEG的Siewert和Nishi分型。在两种分型中,肿物与EGJ的距离并不相同。E:食管U:上1/3胃 M:中1/3胃 L:下1/3胃 D:十二指肠。(图片源自参考文献2) 但目前尚无指南和共识针对EGJ息肉样隆起的区域范围进行定义。 EGJ息肉样隆起的发病机制和诊断? EGJ息肉样隆起相比于食管上段及胃远端病变,具有特殊的生物学行为及疾病预后,目前其发病机制尚不明确,可能与多种因素有关。长期的胃食管反流性病可能引起EGJ处的炎性息肉样病变,病理学显示为贲门黏膜增生,伴或不伴有鳞状上皮细胞,息肉表面常出现充血糜烂,间质往往被炎性肉芽组织所替代,又称为贲门炎性息肉[5]。幽门螺旋杆菌(Hp)是胃癌的危险因素这一观点已得到全世界学者的普遍认可,但与EGJ病变、BarRETt食管、反流性食管炎的关系尚存争议。国外有学者[6]认为Hp能够提高食管下括约肌压力、降低胃内酸度,可能是EGJ病变的保护因素,但亦有学者[7]认为Hp感染是致病因素,原因是当EGJ黏膜损伤导致炎症糜烂时,Hp能够结合于黏液层和上皮细胞膜表面,并呈现聚集生长趋势,释放空泡毒素、尿素酶和磷脂等进一步损伤黏膜上皮细胞,随后炎性细胞浸润,黏膜细胞可能发生萎缩、肠化或异型增生。 EGJ息肉样隆起往往于内镜检查时发现,患者无特殊不适主诉,伴有反流性食管炎时可出现烧心、反酸、胸痛及咳嗽等食管外症状,当有胸痛表现时须与心血管疾病鉴别;当胃酸反流至食管或咽部时,可以刺激管壁内的迷走神经C纤维,出现食管-气道反射,使气道呈高反应状态,表现为咳嗽、喘鸣等[8]食管外表现。EGJ处处于舒缩状态,管腔狭小,因此胃镜检查时应仔细观察才能发现病变。 如何治疗? EGJ息肉样隆起在病理组织学上有多种不同的类型,如BarRETt食管相关的息肉状异型增生、息肉状癌、胃底腺息肉、增生性息肉等、鳞状上皮乳头状瘤、平滑肌瘤等,其中以增生性息肉者最为常见。增生性息肉在炎症的反复刺激性也会发展为上皮内瘤变和局灶癌变,具有恶变潜能[9]。 目前对于EGJ部息肉样隆起的诊疗尚无规范和共识,部分病变合并有反流性食管炎或Hp感染时,抑酸或抗Hp治疗可能有效,但慢性炎性刺激导致黏膜过度增生形成的隆起性病变,在其刺激因素无法根除时,单纯药物治疗很难消退,原则上发现后须切除[2,9,10]。 内镜黏膜下剥离术(Endoscopic Submucosal Dissection,ESD)是治疗EGJ息肉样隆起的推荐治疗方法,术后并发症发生率和复发率低[9,10],不推荐内镜下黏膜切除术(Endoscopic mucosal resection,EMR),因后者很难完整切除因炎症反复刺激增生甚至有粘膜下纤维化的病变全部。 EGJ位置特殊,EGJ息肉样隆起的内镜下治疗存在一定的操作难度,部分需要倒镜下操作。徐美东教授[9]于2018年回顾性分析了经ESD治疗的111例(114处病变)EGJ息肉样隆起性病例。术后病理提示上皮内瘤变及癌变率为18.42%,ESD治疗的整块切除率为100%,治愈切除率为97.4%(111/114),术后2例追加手术治疗,随访中1例复发。数据显示,EGJ息肉样隆起性病变中,伴有上皮内瘤变及癌变并不少见,ESD则是其有效的治疗方法。 总结 EGJ是食管下段和胃上部的一段连接区域,生理状态下舒张收缩交替,该处粘膜上皮容易受到胃内容物反流的刺激,发生炎性增生性改变,长期可能导致上皮内瘤变等癌前病变。胃镜检查时应仔细观察,早期发现病变并进行活检,对于内科治疗无效且伴有高危因素的EGJ息肉样隆起,ESD是安全有效的治疗方法,绝大部分可内镜下治愈。 另外,伴有反流的EGJ息肉样隆起ESD术后其创面的疤痕挛缩愈合也可能有助于减轻反流。 参考文献 1.食管胃结合部疾病跨界联盟 国际食管疾病学会中国分会 CSDE, 中国医师协会内镜医师分会腹腔镜外科专业委员会, 中国医师协会外科医师分会上消化道外科医师专业委员会, 等. 食管胃结合部腺癌外科治疗中国专家共识(2018年版)[J]. 中华胃肠外科杂志, 2018,21(9):961-975. 2.Tsutomu K,Yasunori K, Hirotaka N, et al. True esophagogastric junction adenocarcinoma: background of its definition and current surgical trends. SurgToday.2020Aug;50(8):809-814. 3.Siewert JR, Stein HJ. Carcinoma of the gastroesophageal junction—classification, pathology and extent of resection. Dis Esophagus. 1996;9:173–82. 4.Nishi M, Noumura H, Kajisa T, et al. Surgical problem of carcinoma in the esophagogastric junction. Stomach Intest. 1978;13:1497–507. 5.Shelby DM,Robert MG. Gastric Cardiac Polyps: A Clinicopathologic Study of 330 Cases. Am J Surg Pathol. 2010 Dec;34(12):1792-1797. 6.Rubenstein JH, Inadomi JM, Scheiman J, et al. Association between Helicobacter pylori and Barrett’s esophagus, erosive esophagitis, and gastroesophageal reflux symptoms. Clin Gastroenterol Hepatol, 2014, 12(2): 239-245. 7.Esmat A , Saeid LN, Saber Z, et al. Risk factors predisposing to cardia gastric adenocarcinoma: Insights and new perspectives. Cancer Med. 2019 Oct; 8(13): 6114–6126. 8.Marilena D, Giulia L, Francesca C ,et al. Extra-Esophageal Presentation of Gastroesophageal Re?ux Disease: 2020 Update. J Clin Med.2020 Aug 7;9(8):2559. 9.丁娜, 徐美东, 陈涛等. 内镜黏膜下剥离术治疗胃食管结合部息肉样隆起性病变的临床价值. 中华消化内镜杂志. 2018.06,35(6):400-404. 10.Liu S, Chai N, Lu Z, et al. Long-term outcomes of superficial neoplasia at the esophagogastric junction treated via endoscopic submucosal dissection and endoscopic submucosal tunnel dissection: a cohort study of a single center from China[J]. Surg Endosc, 2020,34(1):216-225.